1913
: Bohr propose une solution : quand les électrons
restent sur leur orbite, ils ne rayonnent pas. Mais, de
temps en temps, ils sautent d'une orbite à l'autre
et là, 2 cas de figure se présentent :
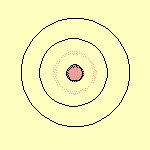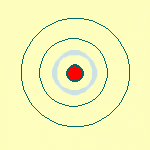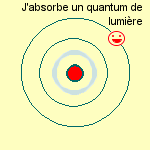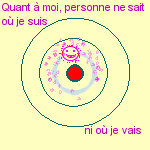 -
soit ils sautent vers une orbite plus large et là
ils émettent un quantum de lumière
(on dit "un quantum, des quanta",
c'est du latin)
-
soit ils sautent vers une orbite plus large et là
ils émettent un quantum de lumière
(on dit "un quantum, des quanta",
c'est du latin)
- soit ils sautent vers une orbite plus proche du noyau,
et là ils absorbent un quantum de lumière.
Comme chaque atome a des orbites différentes, la
lumière émise (ou absorbée) est caractéristique
de chacun.
Animation
explicative, mais incomplète
(voir évolution de la physique quantique qui suit)
Mais
question de plus en plus angoissante :
Comment les physiciens peuvent-ils déterminer
la position et la vitesse des électrons sur leurs
orbites,
puisqu'ils ne rayonnent pas d'énergie lumineuse et
ne nous apportent
AUCUNE INFORMATION !
Pour
connaître la position et la vitesse d'un électron,
il faut le perturber en lui envoyant des photons
: Sinon, c'est le flou.
1924
: le problème s'accroît. Le physicien Louis
de Broglie découvre que ce n'est pas seulement
la lumière qui se comporte à la fois comme
une onde et un corpuscule, mais également les
éléments matériels...
 Acte
III
Acte
III 

